
LAJU REAKSI Cara menentukan persamaan laju reaksi jika zat yang bereaksi ada tiga YouTube
Laju Reaksi: Pengertian, Rumus, Contoh, Soal. Februari 12, 2024 Oleh Eka, S.Si. Banyak reaksi yang terjadi di sekitar kita dengan kecepatan (laju reaksi) yang berbeda-beda. Laju reaksi yang dimaksud di sini adalah laju berkurangnya jumlah reaktan atau laju bertambahnya jumlah produk dalam satuan waktu.

Pengertian Laju Reaksi, Rumus, Hukum, Faktor Pengaruh, dan Contohnya Ilmu Kimia
Persamaan reaksi kimia adalah pernyataan yang ditulis dengan rumus kimia yang memberikan informasi identitas dan kuantitas zat-zat yang terlibat dalam suatu perubahan kimia ataupun fisika.Semua zat yang terlibat dalam reaksi yang di mana jumlahnya berkurang setelah reaksi, disebut pereaksi (reaktan), ditempatkan di sebelah kiri tanda panah yang mengarah ke kanan.

Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11 Belajar Gratis di Rumah
Dalam mempelajari mengenai kinetika reaksi, kamu tentunya juga harus memahami bagaimana cara dan metode yang dilakukan untuk mendapatkan persamaan laju reaksi kimia. Persamaan ini sering juga disebut dengan istilah hukum laju reaksi. Di dalam pembahasan ini, kamu juga akan dituntut untuk mahir dalam mengaplikasikan rumus untuk mendapatkan.

Persamaan Laju Reaksi dan Orde Reaksi Laju Reaksi Kimia Kelas 11 YouTube
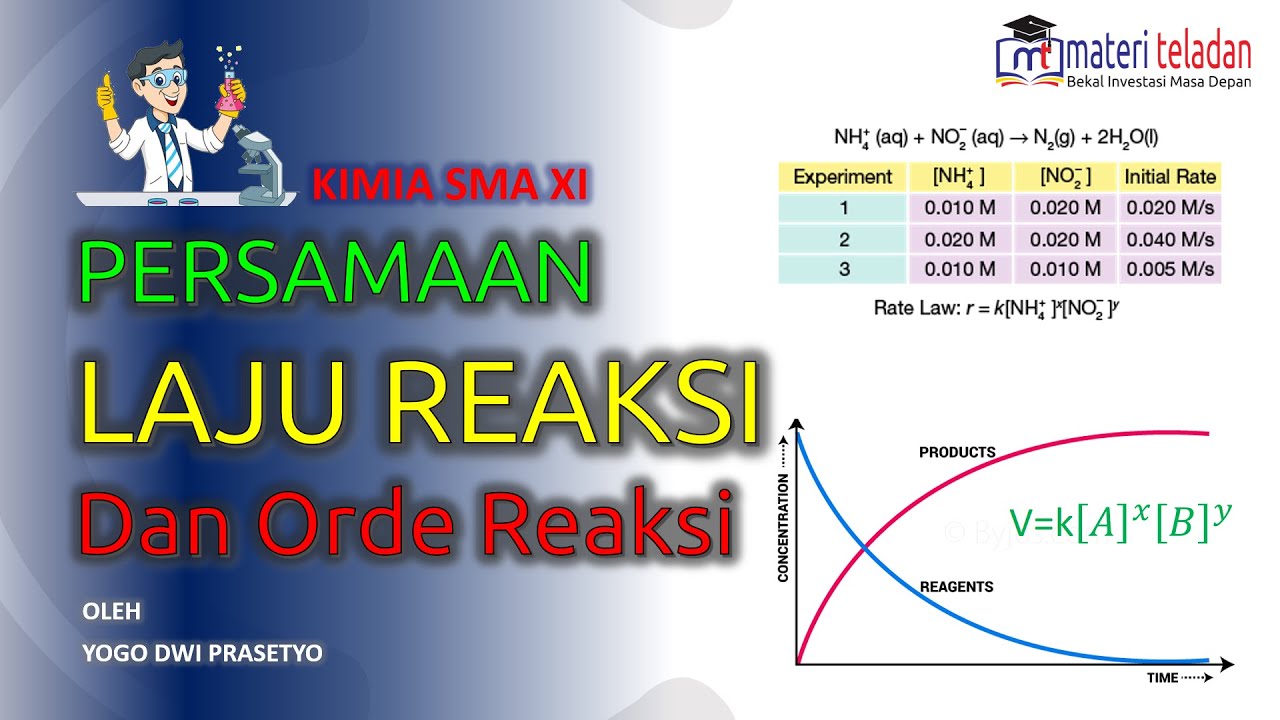
B. Persamaan Laju Reaksi. Persamaan laju reaksi adalah fungsi dari semua pereaksi yang menentukan laju reaksi. Persamaan laju reaksi juga dikenal dengan hukum reaksi. Persamaan laju reaksi dapat dituliskan sebagai berikut : xA + yB → produk. Rumus Persamaan Laju Reaksi. v = k [A]m [B]n. Keterangan: v = laju reaksi [A] = konsentrasi zat A
Persamaan Laju Reaksi dan Orde Reaksi Kimia Kelas 11 YouTube
Rumus Persamaan Laju Reaksi Menurut Modul terbitan Kemendikbud, konsep laju reaksi kimia untuk persamaan reaksi: A → B dirumuskan menjadi: rA= - ∆[A]/∆t atau rB= + ∆[B]/∆t dimana: rA = laju reaksi berkurangnya zat A atau reaktan (mol/L/s) rB = laju reaksi bertambahnya zat B atau produk (mol/L/s) ∆t = perubahan waktu

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA ADA YANG TIDAK SAMA YouTube
Persamaan Laju Reaksi. Photo by Jorge Sepúlveda on Pexels. Ada beberapa data yang diperlukan untuk menentukan laju reaksi, antara lain perubahan konsentrasi reaktan, waktu, konsentrasi awal, volume/massa, dan suhu. Persamaan atau rumus laju reaksi sendiri menggambarkan hubungan matematis antara laju reaksi dengan konsentrasi reaktan.

PERSAMAAN LAJU REAKSI TERINTEGRASI ORDE 2 📈 INTEGRATED RATE LAW 🔥 KIMIA FISIKA YouTube
Dapatkan pelajaran, soal & rumus Persamaan Laju Reaksi lengkap di Wardaya College.. Di sini, kamu akan belajar tentang Persamaan Laju Reaksi melalui latihan soal interaktif dalam 3 tingkat kesulitan (mudah, sedang, sukar).

Persamaan laju reaksi orde reaksi Kimia SMA YouTube
Persamaan Laju Reaksi. Bila diketahui suatu reaksi: lA + mB → nC + oD. Maka persamaan lajunya dapat dinyatakan sebagai. v = k[A]x[B]y. dimana, k = tetapan jenis reaksi. x = orde (tingkat atau pangkat) reaksi terhadap pereaksi A. y = orde (tingkat atau pangkat) reaksi terhadap pereaksi B.

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI DARI TABEL PERCOBAAN YouTube
Orde reaksi pada reaksi secara keseluruhan disebut seaagai orde reaksi total. Besarnya orde reaksi total adalah jumlah semua orde reaksi pereaksi. Sehingga, orde reaksi total (orde reaksi) pada reaksi tersebut di atas adalah m + n. Contoh beberapa reaksi dan rumus laju reaksinya. Persamaan Laju Reaksi dan Orde Reaksi - Contoh Soal dan Jawaban.

Cara Cepat menentukan Laju Reaksi Konsep Dasar tabel MTS YouTube
Persamaan laju reaksi, serta hubungannya dengan molaritas. KOMPAS.com - Persamaan laju reaksi memperlihatkan hubungan antara konsentrasi zat pereaksi (reaktan) dan laju reaksinya.. Persamaan Laju Reaksi (v) adalah hasil kali dari tetapan laju reaksi (k) dengan konsentrasi awal A ([A]) dan konsentrasi awal B ([B]) yang dipangkatkan dengan orde tingkat reaksi A (x) dan orde tingkat reaksi.
Cara Menghitung Laju Reaksi Menggunakan Diferensiasi Grafis
Orde-orde Reaksi. 1. Orde reaksi 0. Laju reaksi tidak bergantung pada konsentrasi. Persamaan reaksi yang berorde 0 yaitu v = k [A]0. 2. Orde reaksi 1. Laju reaksi berbanding lurus dengan konsentrasi pereaksi. Jika konsentrasi dinaikkan dua kali, maka laju reaksinya pun akan dua kali lebih cepat dari semula, dst.

Persamaan Laju Reaksi Penjelasan, Rumus, Contoh Soal dan Jawaban
Persamaan laju reaksi merupakan sebuah persamaan yang memperlihatkan keterkaitan atau hubungan antara laju reaksi tertentu dengan konsentrasi pereaksinya. Baca juga: Mengenal Energi dan Perubahannya dalam Sistem. Coba kamu perhatikan rumusnya, selain ada tetapan laju reaksi, juga ada orde reaksi. Orde reaksi ini beda dengan orde lama ataupun.

PERSAMAAN LAJU REAKSI DAN ORDE REAKSI YouTube
Contoh soal laju reaksi nomor 2. Rumus persamaan laju reaksi yang benar adalah… A. v = k [NO] 2 [Cl 2] B. v = k [NO] [Cl 2] C. v = k [NO] [Cl 2] 2 D. v = k [NO] 2 [Cl 2] 2 E. v = k [Cl 2] Penyelesaian soal / pembahasan. Untuk menjawab soal ini tentukan terlebih dahulu orde reaksi NO dengan cara mengambil data konsentrasi Cl 2 yang sama yaitu.

Contoh Soal Laju Reaksi Dan Penyelesaiannya Berbagai Contoh
Laju Reaksi: Pengertian, Rumus, Contoh, Soal. September 28, 2023 by Vina. Laju reaksi adalah seberapa cepat atau seberapa lambat berkurangnya pereaksi atau terbentuknya suatu produk. Seiring dengan waktu reaksi bertambah, maka jumlah produk yang dihasilkan semakin banyak sementara jumlah zat pereaksinya akan berkurang. Daftar Isi show.

Contoh Soal Laju Reaksi YouTube
Laju Reaksi : Pengertian, Faktor Yang Mempengaruhi, Dan Rumus Beserta Contoh Soalnya Lengkap. Konsep pembelajaran kimia merupakan konsep yang erat dengan kehidupan sehari hari. Kimia menggambarkan kehidupan sedemikian rupa sehingga terlihat lebih rinci dan beragam. Hal ini lah yang membuat para pengajar menerapkan konsep kimia ke dalam.

Pembahasan Persamaan Laju Reaksi Level 3 YouTube
Oleh karena itu persamaan dari materi ini adalah sebagai berikut. Di mana, v= laju reaksi (mol/L/s); = perubahan mol; = perubahan waktu. Di mana, v= Laju reaksi (mol/L/s) ; k= konstanta laju reaksi; n= orde reaksi zat B; m= orde reaksi zat A. Secara logika, pada saat bereaksi, zat reaktan pasti makin berkurang, dan zat produk pasti bertambah bukan?